Cho 10, 35 g 1 kim loại vào 10g dung dịch HCl có nồng độ là C%. Sau khi phản ứng hoàn toàn thu đc 20g hỗn hợp gồm 3 chất rắn. Xác định kl M

Những câu hỏi liên quan
Cho 10,35g một kim ***** tác dụng với 10g dung dịch HCl nồng độ C%. Sau phản ứng thu được hỗn hợp 20g gồm 3 chất rắn .Tìm kim loại
Mn giúp mình với . Cảm ơn mn .
Hỗn hợp rắn X gồm M, MO và MCl2 (M là kim loại có hóa trị II không đổi). Cho 18,7 gam X tác dụng với dung dịch HCl (vừa đủ), thu được dung dịch A và 6,72 lít khí (đktc). Cho dung dịch NaOH dư vào dung dịch A, sau phản ứng thu được kết tủa B. Nung B ở nhiệt độ cao đến khối lượng không đổi thu được 18,0 gam chất rắn. Mặt khác, khi cho 18,7 gam hỗn hợp X vào 500 ml dung dịch CuCl2 1,0M, sau phản ứng, tách bỏ chất rắn rồi cô cạn dung dịch, thu được 65,0 gam muối khan. Biết các phản ứng hóa học xảy r...
Đọc tiếp
Hỗn hợp rắn X gồm M, MO và MCl2 (M là kim loại có hóa trị II không đổi). Cho 18,7 gam X tác dụng với dung dịch HCl (vừa đủ), thu được dung dịch A và 6,72 lít khí (đktc). Cho dung dịch NaOH dư vào dung dịch A, sau phản ứng thu được kết tủa B. Nung B ở nhiệt độ cao đến khối lượng không đổi thu được 18,0 gam chất rắn. Mặt khác, khi cho 18,7 gam hỗn hợp X vào 500 ml dung dịch CuCl2 1,0M, sau phản ứng, tách bỏ chất rắn rồi cô cạn dung dịch, thu được 65,0 gam muối khan. Biết các phản ứng hóa học xảy ra hoàn toàn.
Xác định kim loại M và tính thành phần phần trăm theo khối lượng của các chất có trong hỗn hợp X.
cho e hỏi " Cho 18,6g hỗn hợp A gồm Zn và Fe vào 500ml dung dịch HCl khi phản ứng hoàn toàn cô cạn dung dịch thì thu được 34,575g chất rắn. Lặp lại thí nghiệm trên với 800ml dung dịch HCl rồi cô cạn thu được 39,9 g chất rắn. Tính nồng độ mol của dung dịch HCl và khối lượng mỗi kim loại trong hỗ hợp này"
-Vì khối lượng hỗn hợp kim loại ở 2 trường hợp đều bằng nhau. Chỉ thay đổi lượng HCl. Do trường hợp 800ml HCl thì khối lượng chất rắn tăng lên nên nếu với 500ml HCl mà kim loại hết thì khi tăng lên 800ml HCl thì khối lượng chất rắn không thể tăng lên nữa nên:
-Trường hợp 500ml HCl thì hỗn hợp kim loại dư, HCl hết.
-Trường hợp 500ml HCl thì hỗn hợp kim loại hết, HCl dư.
-Ta sẽ tìm khối lượng mỗi kim loại trong trường hợp 800ml HCl:
-Gọi \(n_{Zn}=x;n_{Fe}=y\)
Zn+2HCl\(\rightarrow\)ZnCl2+H2
Fe+2HCl\(\rightarrow\)FeCl2+H2
Chất rắn thu được là ZnCl2 x mol và FeCl2 y mol
hệ: \(\left\{{}\begin{matrix}65x+56y=18,6\\136x+127y=39,9\end{matrix}\right.\)
giải ra x=0,2 và y=0,1
mZn=65.0,2=13gam; mFe=56.0,1=5,6gam
-Tính nồng độ mol HCl theo trường hợp 500ml HCl vì HCl phản ứng hết.
Cứ 1 mol hỗn hợp kim loại tạo 1 mol hỗn hợp muối thì tăng 71 gam
Vậy x mol hỗn hợp kim loại tạo x mol hỗn hợp muối thì tăng 34,575-18,6=15,975 gam
\(\rightarrow x=\dfrac{15,975}{71}=0,225mol\)
\(\rightarrow n_{HCl}=2x=0,45mol\rightarrow C_{M_{HCl}}=\dfrac{0,45}{0,5}=0,9M\)
Đúng 0
Bình luận (0)
Ngoài ra còn có thể tính cách khác nữa!bạn tự tham khảo nhé!
Đúng 0
Bình luận (0)
khi cho phản ứng với 800ml HCl => khối lượng chất rắn tăng => ở TN1 kim loại dư ,TN2 kim loại hết
gọi số mol Fe=x, Zn =y ta có hệ 56x+65y=18,6
127x+136y=39,9 <=> x=0,1 ,y=0,2
từ TN1 mCl- = 34,575-18,6 =15,975 =>n=15,975/35,5 =0,45 mol
CM =0,9 , mFe =5,6
Đúng 1
Bình luận (2)
Cho 8,3 gam hỗn hợp X gồm Al, Fe (
n
Al
n
Fe
) vào 100 ml dung dịch Y gồm
Cu
NO
3
2
và
AgNO
3
. Sau khi phản ứng kết thúc thu được chất rắn Y gồm 3 kim loại. Hòa tan hoàn toàn chất rắn Y vào dung dịch HCl dư thấy có 1,12 lít khí th...
Đọc tiếp
Cho 8,3 gam hỗn hợp X gồm Al, Fe ( n Al = n Fe ) vào 100 ml dung dịch Y gồm Cu NO 3 2 và AgNO 3 . Sau khi phản ứng kết thúc thu được chất rắn Y gồm 3 kim loại. Hòa tan hoàn toàn chất rắn Y vào dung dịch HCl dư thấy có 1,12 lít khí thoát ra (đktc) và còn lại 28 gam chất rắn không tan Z. Nồng độ mol của Cu NO 3 2 và của AgNO 3 lần lượt là:
A. 2M và 1M
B. 0,2M và 0,1M
C. 1M và 2M
D. 1,5M và 2M
Hòa tan hoàn toàn 9,45 gam hỗn hợp X gồm nhôm và đồng vào 500 ml dung dịch HCl sau khi phản ứng kết thúc thu được dung dịch A, chất rắn B và 5,04 lít khí H2 ở đktc.
a/ Tính % khối lượng mỗi kim loại trong hỗn hợp?
b/ Tính nồng độ mol của dung dịch HCl đã dùng? Biết lượng HCl dùng dư 10% so với lượng đã phản ứng?
$a)PTHH:2Al+6HCl\to 2AlCl_3+3H_2$
$n_{H_2}=\dfrac{5,04}{22,4}=0,225(mol)$
$\Rightarrow n_{Al}=0,15(mol)$
$\Rightarrow \%m_{Al}=\dfrac{0,15.27}{9,45}.100\%\approx 42,86\%$
$\Rightarrow \%m_{Cu}=100-42,86=57,14\%$
$b)$ Theo PT: $n_{HCl}=2n_{H_2}=0,45(mol)$
$\Rightarrow C_{M_{HCl}}=\dfrac{0,45.110\%}{0,5}=0,99M$
Đúng 5
Bình luận (0)
Cho 8,3 gam hỗn hợp X gồm Al, Fe (có tỉ lệ mol là 1 : 1) vào 100 ml dung dịch Y gồm Cu(NO3)2 và AgNO3. Sau khi phản ứng kết thúc thu được chất rắn A gồm 3 kim loại. Hòa tan hoàn toàn chất rắn A vào dung dịch HCl dư thấy có 1,12 lít khí thoát ra (đktc) và còn lại 28 gam chất rắn không tan B. Nồng độ CM của Cu(NO3)2 và của AgNO3 lần lượt là: A. 2M và 1M. B. 1M và 2M. C. 0,2M và 0,1M. D. kết quả khác.
Đọc tiếp
Cho 8,3 gam hỗn hợp X gồm Al, Fe (có tỉ lệ mol là 1 : 1) vào 100 ml dung dịch Y gồm Cu(NO3)2 và AgNO3. Sau khi phản ứng kết thúc thu được chất rắn A gồm 3 kim loại. Hòa tan hoàn toàn chất rắn A vào dung dịch HCl dư thấy có 1,12 lít khí thoát ra (đktc) và còn lại 28 gam chất rắn không tan B. Nồng độ CM của Cu(NO3)2 và của AgNO3 lần lượt là:
A. 2M và 1M.
B. 1M và 2M.
C. 0,2M và 0,1M.
D. kết quả khác.
choa khí CO dư đi qua ống sứ nung nóng chứa m(g) hỗn hợp X gồm 2 oxit của 2 kim loại thu được chất rắn A và khí B.cho toàn bộ khí B vào dung dịch nước vôi trong dư thu đc 1,5g kết tủa.cho toàn bộ chất rắn A vào dung dịch H2SO4 10%(vừa đủ) thì thu được dung dịch muối có nồng độ 11,243% không có khí thoát ra, còn lại 0,96g chất rắn không tan. Xác định công thức của 2 oxit biết rằng các phản ứng đều xảy ra hoàn toàn.
Đọc tiếp
choa khí CO dư đi qua ống sứ nung nóng chứa m(g) hỗn hợp X gồm 2 oxit của 2 kim loại thu được chất rắn A và khí B.
cho toàn bộ khí B vào dung dịch nước vôi trong dư thu đc 1,5g kết tủa.
cho toàn bộ chất rắn A vào dung dịch H2SO4 10%(vừa đủ) thì thu được dung dịch muối có nồng độ 11,243% không có khí thoát ra, còn lại 0,96g chất rắn không tan. Xác định công thức của 2 oxit biết rằng các phản ứng đều xảy ra hoàn toàn.
cho chất rắn A vào
đặt 2 công thức oxit là R2Oa và M2Ob
không có khí thoát ra => có 1 oxit ko bị khử ( M2Ob)
0,96 g chất rắn => R
pt hóa học
R2Oa + aCO --->(có to ở trên nha) 2R + aCO2 (1)
M2Ob + CO --x-->
vì Ca(OH)2 dư => nCO2 = n kt CaCO3 = 1,5/100 = 0,015
từ pt (1) => nR = 2.nCO2 / a = 0,03/a
mR = 0,03R/a = 0,96
với a=2 => R=64(Cu) Thỏa mãn
=> CT R2Oa là CuO
giả sử có 1 mol M2Ob tham gia phản ứng
M2Ob + bH2SO4 -> M2(SO4)b + bH2O
1 b 1 (mol)
m d d H2SO4 10% = 98b/10% = 980b (g)
md d sau phản ứng = 1(2M+16b)+980b=2M+996b
C%M2(S04)b = (2M + 96b)/(2M+996b) .100%=11,243%
(2M + 96b)/(2M+996b)=0,11243
2M + 96b =0,11243(2M+996b) = 0,22496M + 111,98028b
=> 1,77514M=15,98028b
=>M=9b
b=3=>M=27 (Al) Thỏa mãn
vậy ....
học tốt
Cho 51,75g kim loại R (hóa trị II) vào 200g dung dịch CuSO4 16%, sau khi phản ứng xảy ra hoàn toàn thì thu được dung dịch X và 51,55g hỗn hợp kim loại. Xác định kim loại R và tính nồng độ phần trăm của chất tan có trong X
Xem chi tiết
PTHH: \(R+CuSO_4\rightarrow RSO_4+Cu\)
Ta có: \(n_{CuSO_4}=\dfrac{200\cdot16\%}{160}=0,2\left(mol\right)=n_{Cu}=n_R\)
\(\Rightarrow m_{Cu}=0,2\cdot64=12,8\left(g\right)\)
Theo bài ra, ta có: mhỗn hợp = mR ban đầu - mR pư + mCu
\(\Rightarrow51,75-m_{R\left(pư\right)}+12,8=51,55\left(g\right)\)
\(\Rightarrow m_{R\left(pư\right)}=13\left(g\right)\) \(\Rightarrow M_R=\dfrac{13}{0,2}=65\) \(\Rightarrow\) R là Kẽm
Mặt khác: \(m_{dd}=m_{R\left(bđ\right)}+m_{ddCuSO_4}-m_{Cu}-m_{Zn\left(dư\right)}=225,95\left(g\right)\)
\(\Rightarrow C\%_{ZnSO_4}=\dfrac{0,2\cdot161}{225,95}\cdot100\%\approx14,25\%\)
Đúng 1
Bình luận (0)
Câu 8: Cho 8,3g hỗn hợp X gồm Fe và Al vào 1lít dung dịch CuSO4 0,2 M, sau khi phản ứng xảy ra hoàn toàn thu được 15,68g chất rắn Y gồm 2 kim loại.
a) Tính thành phần phần trăm theo khối lượng của từng kim loại trong hỗn hợp X.
b) Tính nồng độ mol/l của các chất tan trong dung dịch sau phản ứng.
c) Trình bày phương pháp hoá học để tách riêng từng kim loại trong Y.
a, 2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
x…………3/2.x
Fe + CuSO4 → FeSO4 + Cu
y……..y
Al phản ứng hết với CuSO4 sau đó Fe mới phản ứng với CuSO4. Vì sau phản ứng thu được rắn Y gồm 2 kim loại nên Al đã tan hết và Fe có thể đã phản ứng 1 phần hoặc chưa phản ứng. 2 kim loại trong Y là Fe và Cu.
⇒ nCu = nCuSO4 = 0,2.1 = 0,2 mol
⇒ mFe dư = mY - mCu = 15,68 - 0,2.64 = 2,88g
Đặt số mol Al ban đầu là x, số mol Fe phản ứng là y, ta có hệ phương trình:
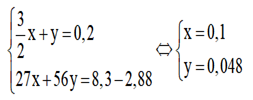
⇒ mAl = 0,1.27 = 2,7g
⇒ %mAl = 2,7/8,3.100 = 32,53%
Đúng 1
Bình luận (0)























